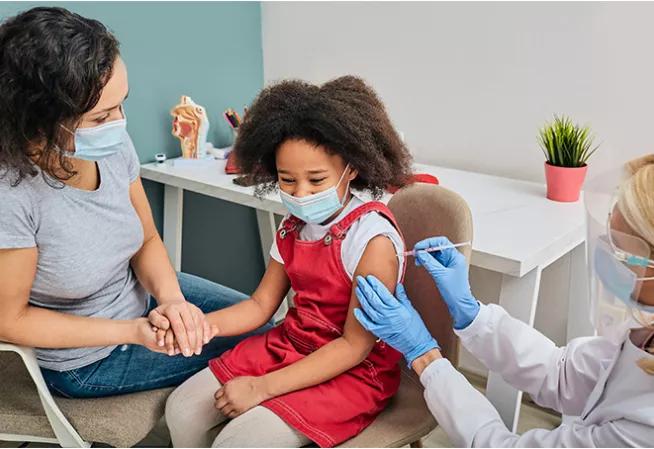
Pour vous, votre famille, vos proches, vous vous posez des questions sur la vaccination contre le Covid-19. Le Ministère des Solidarités et de la Santé publie des foires aux questions sur les différents sujets concernant la vaccination : la campagne de rappel ; la vaccination des mineurs ; les personnes en situation de handicap ; la vaccination après une infection au COVID-19...
COVID-19 Foire aux questions (FAQ) - Vaccination
Article
Le Ministère des Solidarités et de la Santé publie plusieurs foires aux questions pour répondre aux différentes questions sur la vaccination.